INTERVIEW
クオリプス〜世界初、iPS細胞由来の再生医療等製品の実用化を目指して〜

クオリプス株式会社 代表取締役社長
澤 芳樹(さわ よしき)
クオリプス株式会社 取締役最高技術責任者
大阪大学大学院医学系研究科特任教授 医学博士

クオリプス株式会社
iPS細胞等、再生医療等製品の研究開発、製造・品質プロセスや供給体制の最適化に強み。 大阪大学が実施するiPS細胞由来心筋細胞シートの医師主導治験を支援
JICベンチャー・グロース・インベストメンツ株式会社 プリンシパル
心不全で亡くなる人をどう助けるかをテーマに
浅井:まず澤先生にお伺いしたいのですが、大阪大学心臓血管外科のこれまでの歴史と開発方針について教えていただけますでしょうか?例えば、テルモと共同でハートシート(ヒト(自己)骨格筋由来細胞シート)を開発された実績等が知られています。
澤:大阪大学心臓血管外科には100年の歴史があります。医療に関わるものとして、患者を助けるために心臓移植と人工心臓治療を進めてきました。私たちは再生医療の研究者でもなければ、再生のラボではありません。心不全で亡くなる人をどう助けるかを究極のテーマとしています。 1999年の2月28日に日本で初めて臓器移植法に基づく心臓移植手術を行い、それ以後、教室では心臓移植を推進してきました。アメリカでは1968年に統一死体提供法が成立し脳死の概念(Harvard Criteria)が確立していましたが、日本では法律の制定自体がアメリカと比べ31年遅れてスタートしています。それに加え、日本の法律が厳しく、患者にも限りがあり、なかなかアメリカに追いつかないという状況でした。そうした中、大阪大学の心臓血管外科は再生医療の研究に取り組み始めました。ES細胞ができて再生医療という言葉が初めて出てきた時期です。僕はその前に細胞治療として基礎研究を行っていて、東京女子医大の岡野先生たちと知り合って共同研究を始めました。それまで岡野先生たちも臨床応用はあまり考えていなかったのですが、我々は細胞シート技術を導入して、足の筋肉の細胞を使った再生療法の研究開発を2004年から開始して、2007年には臨床応用をスタートしました。その頃、テルモでは、足の筋肉の細胞に含まれる筋芽細胞を培養するFDA承認の技術を導入していたので、心臓外科として共同で取り組むことになりました。 テルモ側では、カテーテルを利用した細胞注入、つまりインジェクションでやろうとしていたのですが、その方法では不整脈が多いのです。患者さんの大腿部から採取した筋肉組織に含まれる骨格筋芽細胞を培養してシート状に調製したハートシートの方が、安全で有効ですと提案して共同研究が始まりました。 2012年にテルモが治験を始めて2014年に製造販売承認申請され、2015年からは製造販売承認されました。実施施設もいまはもう10施設ぐらいになり、施設と再生医療技術を展開するチームが完成しています。どういう患者さんなら有効かということも、段々みんなにわかってきていて、現段階で100例近くハートシートを使った治療が実施されています。
画期的な再生医療等製品を多くの人びとに届けるために
浅井:再生医療の研究の過程で、2017年にクオリプスを設立された経緯を教えてください。
澤:足の筋肉の細胞を使った再生療法の研究開発では、細胞開発はテルモに任せることにして、僕らは臨床応用に取り組みました。
2007年にファーストインヒューマンを行う直前の2006年8月に、天の配剤というか、山中伸弥先生がiPS細胞の樹立に成功したんですね。
僕らは足の筋肉を使った心筋細胞シートで臨床応用を始めていたのですが、ぱっと見てすぐわかるほどの違いがあり心筋細胞でやるべきだと思い、2008年から研究開発を始めました。山中先生の研究に対する評価が高かったこともあり、政府機関からたくさんのグラントをもらいながら、動物実験に成功しました。世界で最初のプルーフオブコンセプトを出せたのは2012年9月です。これは、Circulationという論文で報告しています。
その後の2012年10月に山中先生がノーベル生理学・医学賞を取って、ここから状況が大きく変わっていきました。
2013年に文科省・JSTで大型事業の再生医療実現拠点ネットワーク事業(2015年よりAMED*に移行)が始まり、四つの拠点が選ばれて、そのうちのひとつが我々の大阪大学でした。大阪大学は、心筋再生治療創成拠点となり、そこから研究開発が一気に加速しました。5年でファーストインヒューマン、10年で実用化に結びついたのは、これまでにない規模のグラントであったことも大きいのですが、同時にハードルもとても高いものでした。
*AMED: 国立研究開発法人日本医療研究開発機構
動物実験はそれほど難しくないのですが、これまでやったことがないレベルのレギュラトリーサイエンス、つまり、商品として申請に値する安全性・有効性を精度高く証明することは大変でした。造腫瘍性、つまりがん化リスクをどう克服するか、大量培養をどうするか、こうした課題をAMEDの資金を活用しながら段々と解決していき、2015〜16年くらいに実用化目前の段階にきました。
しかし、大学としては製造販売業の許可が取れないため、大学発ベンチャーとして会社を設立して、技術移転をしながら製品化に結びつけようという話が進み、2017年にクオリプスを設立しました。
製薬企業と連携するのかも課題でした。その頃はちょうど、中山讓治氏が第一三共の会長に就任し、アスビオファーマを完全子会社化した時期でした。アスビオファーマは、再生医療の研究開発を進めていたのですが、その中山氏が僕のところにこられて、一緒にやりたいと声をかけてくれたのです。アスビオファーマ側が開発していた技術と、クオリプスの臨床に応用する勢いをあわせて、開発を早めていくことになりました。
製品化・商品化という意味では、製造コストを踏まえるとアカデミアとしてはためらいがありましたが、うまくできれば早く製品化できて、早く人に届けることができると思い取り組むことにしました。
第一三共がクオリプスに投資をすることになり、世間はとても驚いたようです。神戸で研究を進めていたアスビオファーマのグループは、第一三共から出向する形で大阪大学のラボに移ってきました。
いよいよ臨床研究スタートというときに大阪北部地震で振り出しに
浅井:最終的には、アスビオファーマのチームがクオリプスに合流したということですね。
澤:そうです。製薬企業は製造を強く意識するので、製造施設を早く作らないといけないと考えるようになり、僕らはまず大阪大学の中で培養してから次のステップに行こうと考えていました。拠点事業でまず基礎的な研究をしっかりして、段々造腫瘍性も克服されて大量培養がかなうようになり、ちょうど5年目の2018年に臨床研究の申請をしたのです。その年の5月16日、申請が承認されていよいよ臨床研究のスタートだと意気込んだ翌月、6月18日に震度6強の直下型地震、大阪北部地震があって大阪大学の細胞培養施設が全部壊れてしまい、細胞培養を一からやらないといけない事態になりました。いざ臨床研究という時に細胞培養施設が壊れ、培養をやり直さなければいけないという状況になり、1年間の観察が必要となる造腫瘍性試験も振り出しに戻ってしまいました。
浅井:あの地震の時には、造腫瘍性試験が走っていたんですね。
いよいよiPS細胞由来の心筋細胞の治験臨床研究へと
浅井:その後はどうなさったのでしょうか?
澤:造腫瘍性試験が走っていて、臨床研究用のiPS由来心筋細胞をある程度製造していた時でした。地震の影響を踏まえて、一度製造した細胞も全部廃棄処分し、一からまた作りなおしました。結果として開発計画が1年半遅延しました。ただ、遅れはしましたが、予定どおり臨床研究に入っていたとしたら、治験に移行し論文化するまで皆さんに説明するタイミングがなかったかもしれません。一方で、2019年の後半ぐらいにCLiC-1(クリックワン、Cuorips Labo-integrated Cell Processing Facility for Advanced Therapy-1st)で治験用の細胞の準備が段々できてきました。奇跡のようなストーリーですが、CLiC-1でのiPS細胞由来の心筋細胞の製造にめどが立ち、その後は順調に進みました。結果的に、iPS由来細胞を大阪大学で製造できなくなったことによる遅れは、CLiC-1で製造できることになったおかげで3ヶ月ぐらいに縮まりました。当初、2018年から19年にかけて臨床研究を始め、治験は2020年ぐらいから何例かやろうとしていました。しかし、臨床研究が遅れていたがゆえに、治験から入ることにしました。その方がシンプルなのです。いろいろな移植の技術とか患者選択とか、もう既にテルモと大阪大学の先行研究でしっかり確立していましたから。多くの人がいきなり治験をやっても、多分失敗します。どんな患者を対象とするかの検討が難しいからです。だけど僕らはハートシートで治験を実施した際に、臨床研究を数十例経験していたため、患者選択もずいぶんうまくやれたので、条件・期限付きで早期承認されています。その経験をさらに上積みして、今回の治験に入ることができたのは、ものすごく幸いです。振り返ってみると、地震のおかげで治験は逆に早まりました。2020年1月、7月、11月とコロナの最中ですら3例は終わって、コホートBに進むようなデータを出せるようになりました。
浅井:コホートBが当局から承認されたのはいつ頃でしたか?
澤:コホートB*が承認されたのは、2021年の8月です。コロナの第5波の頃で、その後の6波、7波、8波は、コロナ感染者数がとても多かったため、治験への患者組み入れが難しくなりました。ただ、その間にしっかりとiPS細胞由来の心筋細胞の搬送方法を最適化でき、72時間保存できる方法まで確立したので、去年の8月から現在までで5例実施できました。治験にご協力いただいた大学病院の先生方が患者選定の手法にとても習熟していたことも、治験がスムーズに進んだ理由のひとつです。
*コホートB:医師主導治験の後半部分。5例の患者を対象としており、2022年9月に第1例目の移植手術が実施され、2023年3月に第5例目の移植手術が実施された。前半部分であるコホートA(3例)との違いは、①自社施設(CLiC-1)で心筋細胞シートを製造・培養した点と②他施設で移植手術がおこなわれた点。同社はコホートBで、心筋細胞シートを商用スケールで製造するとともに輸送方法の確立に取り組んできた。

心筋梗塞の発作で心筋がダメージを受ける虚血性心疾患
浅井:iPS細胞由来心筋シートが対象となる虚血性心疾患について、改めてご説明いただけますでしょうか。
澤:虚血性心疾患というのは心筋梗塞の度重なる発作によって、心筋がどんどんダメージを受けて、生きている心筋が少なくなっていく病気です。そうした症状が進行すると、最後は心臓移植か人工心臓しかないという状況であり、医療者の間ではノーオプションと言われます。この段階が、再生医療の適用時期と考えています。 虚血性心筋症ではいろいろな薬が利用できますが、薬で根治することは少ないのです。医薬品を服用し、徐々に病態が進行するとバイパス手術やPCI(経皮的冠動脈形成術)を実施します。その後、数年かけて段々悪くなり、心臓移植や人工心臓が必要なハイバネーションの状態になります。ハイバネーションとは、冠血管の狭窄あるいは閉塞により心筋血流の低下が持続した結果、壊死は伴わずに心筋収縮力のみ低下した状態です。最後まで悪くなってしまったら、心臓がショック状態になるのですが、そこまでいくともう正常に機能する心筋が少なく、人工心臓が必要になります。まだ正常な心筋細胞が多く、でも薬が効かない状態がiPS細胞由来心筋シートによる治療のタイミングです。 私の考えでは、こうした局面にいる患者は、年間数万人はいます。カテーテル治療を行うのは、日本にいる虚血性心疾患の患者さん20万人のうち10%から20%くらいです。さらに、バイパス手術はだいたい年間1万人なので、あわせて3〜5万件前後はいるでしょう。アメリカにはその5倍から10倍の対象者がいます。
治療後に心臓が小さくなるメカニズムとは
浅井:これまでの治療で、一度悪くなった心臓が戻る事例はあるのでしょうか?
澤:それはたくさんあります。例えば運動耐容能という検査がありますが、この数値がとても上がります。一般的な指標として、EF、つまりイジェクションフラクション*がいくつとか言いますね。なぜかというとEFとは、心臓の一番伸びた時と縮んだ時の差を言っているわけです。
*イジェクションフラクション: ejection fraction、駆出率。心機能のうち、心室収縮機能の代表的な指標。左室の収縮力(ポンプ能力)を測ることができる。心拍ごとに心臓が放出する血液量(駆出量)を拡張期の左心室容量で割った値。通常の駆出率は50〜60%以上。
ハートシートの治療をすると心臓が小さくなります。これは、心臓が柄杓のような働きをするからです。汲み出す力が段々弱くなっていくと、心臓は大きくなることで対応します。だから伸びた時と縮んだ時の差が、段々小さくなっていくのです。最初は伸びる時と縮む時の差が60%くらい。心臓が大きくなると縮んだ時との差が減って30%ぐらいになります。EFは指標として大切なのですが、さらにPeakVO2(最高酸素摂取量)も見ていく必要があります。クオリティオブライフがどれだけ良くなるかが大切だからです。ハートシートの添付文書でも、6例治験組入れ患者のPeak VO2の中央値は、手術前の11.8が手術後に14.5まで上昇しています。ちなみにハートシートでも、EF自体はそれほど変わりません。上がっても数%改善するかどうかですが、生命予後は明らかに向上します。5年生存率が80%以上、85〜90%ぐらいです。同じ患者で内科治療を行った場合、5年生存率は50%から60%とされています。
運動耐容能の数値が改善される理由
浅井:2022年に報告された論文では、心筋細胞シートを移植された患者1名の運動耐用能が改善(PeakVO2(mL/min/kg):15.4(移植前)→18.7(術後半年)→20.0(術後1年))されたと報告されています。運動耐容能の数値が改善される理由はなんですか?
(ご参考)2022年8月の報告論文より引用
図. ヒトiPS細胞由来心筋細胞シートの移植及び移植前後の拍動パターン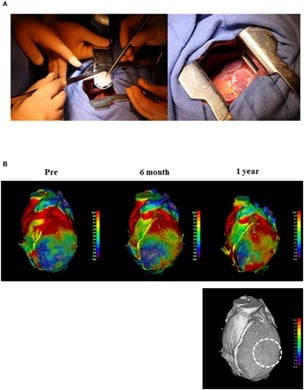
(A)重症心筋症患者の心臓表面へのヒトiPS細胞由来心筋細胞シートの移植。
左:IABPサポート下で第4肋間からLVの前壁と側壁の心外膜に移植された。 右:3枚のパッチがLV前壁と側壁の心外膜に移植された。
(B)四次元CTで観察された心筋移動パターン。 色は赤が良好な運動領域を示し、色が青に近づくにつれて動きが小さいことを示すように設定した。画像は移植前(pre)、移植6ヶ月後、移植1年後の心臓の移動パターンを時系列に示している。
下図の点線はパッチを貼り付けた部分。 LV:左心室 IABP:大動脈内バルーンパンピング CT:コンピュータ断層撮影。
Miyagawa, S. et al. (2022) Front Cardiovasc Med
澤:PeakVO2が改善されるのは、移植後に心臓が小さくなって柔らかくなるからと考えられています。ご存じの通り、血液は右心室から肺、そして左心房へと流れます。その際、心臓が収縮する直前に心室にかかる負荷を前負荷といい、心臓が収縮した直後に心臓にかかる負荷を後負荷といいます。このとき、前負荷と後負荷との関係で見ると、前負荷が減るほどに楽になります。心臓の筋肉が回復し、柔らかくなり心臓全体が小さくなると肺への負担が減ります。すると呼吸がしやすくなる。そういうメカニズムをしっかりわかっていたら、なるほど、PeakVO2が改善するということは、これは心臓の筋肉が回復し、楽になったから運動耐容能が上がったな、だから患者が楽になった、元気になったと理解できます。
これまでの治療の限界を超えたiPS細胞由来の心筋細胞シート
浅井:自家細胞と同種(他家)細胞では、どのような違いがあるのでしょうか。
澤:自家細胞は、患者さんその人のコンディションと細胞の性質によって変わります。心筋細胞に分化して増殖する人としない人、治療の可能性のある人とない人、大きくばらつきがあります。自家細胞は一見安全だと思われます。確かに安全性については、自家の方がいいかもしれません。他家細胞の場合は、心筋では免疫抑制剤を使わなくてはいけない。ただ、免疫抑制剤の使い方については、精緻に研究してあります。僕は医師として心臓移植をやっているから、免疫抑制剤の使い方をよくわかっていますが、経験則として3ヶ月飲ませた方と3ヶ月以上飲ませた方の再生された効果は一緒と理解しています。これは、カニクイザルでの実験でも同じでした。(ご参考、Kashiyama, N. et al. (2019) Transplantation)有効性だけを考えたら、必ずしも他家と自家の問題ではなく、iPSとiPSでないことの違いといった方がいいでしょう。iPSは他家ですが、これは同じ人から同じように作っているから、製品においての効果の安定性は抜群です。iPSは、今のところ他家を選ばざるを得ませんが、将来は自家を選べるかどうか、そこはまた難しいところです。
浅井:患者から見た際の負担について、免疫抑制剤の投与以外はどのような違いが自家細胞とiPS由来心筋細胞シートでありますか。
澤:自家細胞を培養するハートシートでは、手術は2回しないといけません。しかし、Ready to goで用意されているiPS由来心筋細胞シートの場合は、1回の手術で済みます。
浅井:iPS由来心筋細胞シートの場合は、患者さんの負担が小さくなっているということですね。
澤:さらに言うと、開胸することの負担やリスクはそれほどではありません。手術が1回で済むことが自家と比べた場合のメリットです。
浅井:2023年2月の九州大学での記者発表では、患者さんのコメントがとても印象的でした。患者さんは医師から「もうこれ以上治療はありません」という宣告を受けた上で、iPS細胞の治験の紹介を受けて実施されました。すると、いままでは冬場になると胸が締め付けられるような感触があったのに、手術を受けたあとは体の腫れ感がなくなっていたり、体が温かくなるように感じたりといった感想を述べていました。
澤:体が温かくなるように感じるということは、過去に心臓移植を受けた患者さんはみなさんおっしゃいます。全身の血液の循環が悪い時には、末梢血管を閉めて血圧を維持しようとするので冷えを感じます。それが温かく感じるということは末梢血管が開く、すなわち循環が良くなっているということです。患者さんの状態を端的に言い表していると僕は思います。
浅井:すごいですね。心臓の腫れ感がなくなったとか、なかなか論文では見ることのできない実感ですね。
澤:皆さんそれぞれに仕事や日常生活に困難を抱えていらっしゃったのですが、8名が社会復帰を果たし元気に仕事をしています。
iPS細胞由来心筋細胞シートの製造拠点CLiC-1
浅井:心筋細胞シートの開発では、クオリプスはどのような役割を果たしたのか聞かせていただけますか。
草薙:基本的には私たちの取り組みは、澤先生の研究をベースにして心筋細胞の製造をしているということです。澤先生のコホートB以降の治験で用いた心筋シートについては、すべて私どもの製造施設であるCLiC-1で製造したものを患者さんに移植しています。
澤:10年目にして治験を終えて社会実装が見えて来たのは、とても大きなことだと思っています。
浅井:心筋細胞シートの製造以外にも、さらに大きな展望があるように聞いていますが、聞かせていただけますでしょうか。
草薙:そうですね。現在のプロダクトは、どちらかというと重症な心不全の患者さんが対象です。私どもとしては、もう少し軽症の人たちの心臓に対応するためにカテーテルの開発を行っています。また、CLiC-1のような製造施設をもっているベンチャーは非常に珍しいので、この製造設備を利用する形でCDMO事業*を行っています。具体的には、私どものような小規模なベンチャーさんの臨床研究や承認後の製品作りをお手伝いする事業です。さらには、プロダクトの分散化としてYS開発と私どもは呼んでいるのですが、再生因子誘導医薬の開発を行っています。
*CDMO事業:Contract Development and Manufacturing Organizationの略。開発・製造受託事業。
澤:CDMOについては、僕らもあまり想定していませんでした。iPS細胞の培養は簡単ではないのですが、我々は心筋細胞を大量に培養しています。こうした細胞培養技術を信頼していただけたのだと思います。国内の他の開発品は多くても数百万個の細胞数です。我々は億の単位ですから、技術的にも何十人、何百人分の培養をする技術の高さが信頼を得ているのだと思います。
草薙:そうですね。先生がまさにおっしゃった通りで、やはり培養技術が非常に進んでいるということは大きなアドバンテージになっていまして、引き合いも多く来ています。

基礎研究、臨床力、資金、製造施設が揃ったベンチャーとして
浅井:創薬領域のバイオベンチャーは、調達面や人の採用で苦しむことが多いのですが、成功の要因はなんだとお考えですか?
草薙:やはり澤先生の存在が大きいですね。澤先生は、理論と臨床、実際の経験をミックスして物事を進めるので、応用面でうまくいっています。資金調達の面では、いろいろなベンチャーファンドと話をしてきました。その中でも、浅井さんからの質問は、内容も一番的確でした。それから、こういうところで困っています、こういう人を知りませんかと相談をすると、すぐに対応してくれます。こうした対応は、インキュベーションという意味でも、非常に貢献度が高かったといえます。
澤:大阪大学心臓血管外科には100年の歴史があるわけですが、とてもタフな教室です。そこに残る言葉のひとつに「最後は人柄」というものがあります。仕事の成功の秘訣は、やっぱり人柄でしょうね。
草薙:政府系ファンドの出資を得たことで、クオリプスの対外的な信用力も高まりました。基礎研究、臨床力、資金、それから製造施設が揃ったので、ベンチャーとしてはかなり成功している部類に入ると思います。
浅井:デューデリジェンスをした時に思ったのですが、薬事でも澤先生が参加され、PMDAとの交渉などにも関わっていたので安心感がありました。
草薙:僕は、澤先生は再生医療業界の大谷翔平だと言っているのですよ。澤先生の場合4刀流くらいですが。オールマイティというか、好奇心旺盛な方なので。自分の領域だけで他のことに関心がない研究者が多い中で、多方面にアンテナを張っている澤先生は、特別な存在です。
浅井:企業との連携についても、たくさんの案件が澤先生のところに集まっている印象を受けました。

世界初のiPS細胞由来再生医療等製品で世界の医療スタンダードへと
浅井:まさにビジネスの拡張期に入る中、自社研究や共同研究が進み、製造もおこなっていくということですね。採用もこれから加速するのではないですか?
草薙:そうです。雇用の創出、あるいは産業の育成、クラスターの形成を我々としては目指していきたいと考えます。いわゆるエコシステムですね。我々のようなリーダー役がいて、そこからいろいろな技術が降りていき、さまざまな会社が出てきてひとつの大きな産業をつくりだしていくような、ベンチャーのエコシステムですね。我々にとっては、挑戦する価値のある、やりがいのある仕事です。
浅井:このiPS細胞由来の心筋細胞シートが承認されれば、世界初のiPS細胞由来の再生医療等製品ということになります。それをエコシステムに展開していくということですね。
草薙:そうですね。さらに、澤先生と一緒に海外に出ていく。そんなグローバルな産業ができていくことを目指しています。
澤:アカデミアの欲望は尽きない、というと語弊があるかもしれませんが、世界中の人を治したいと思っています。日本の人だからではなく、心不全の人を治す手応えがありますから、これなら世界の人を治せると思っています。だから国内にこだわらず、世界に展開したいと思っています。日本から発信して、世界の医療のスタンダードになった製品はまだ足りないと思います。だからこそ、我々の会社が海外に出ていって成功を収めることは、日本にとっても意味は大きいことでしょう。まして、山中先生がノーベル賞を取って、国が再生医療に舵を切ったわけで、1,000億円くらいの投資がこの10年間でなされていますから、それをもとに再生医療等製品が展開される意味は大きい。そして、心臓は命に直結しているので、やはりニーズが大きいでしょう。もちろん他の病気と比べるものではありませんが、特に心臓は、アメリカをはじめ欧米では死亡原因の一番です。それを何とか解決するクオリプスとして、グローバルな存在になってくれたらと会社に対しても思うし、僕らが開発したものが世界で通用して世界の人を救える、これほどアカデミアとしていいことはありません。
浅井:コホートBが終わられたということで、いよいよアメリカに向けて準備されるということですかね。
草薙:そうですね。その時に向けて準備を進めています。
澤:アメリカには私の知り合いもたくさんいますし、部下もアメリカで活躍しています。ネットワークがしっかりしているので、アメリカでの展開を楽しみにしています。
浅井:私も楽しみにしています。今日はありがとうございました。

最終更新日:2023年6月22日

